呋喃解草唑的合成研究进展
来源《世界农药》2023年第3期
转载请注明来源
作者:李宇桐,黄海芳,李雪,宋海文,董志鹏,郭庆春,张越
呋喃解草唑(furilazole,图1)是孟山都公司开发的一种二氯乙酰胺类除草剂安全剂,化学名称为3-(二氯乙酰基)-5-(呋喃-2-基)-2,2-二甲基唑烷。其与异唑草酮、豆黄酮、磺酰脲类、咪唑啉酮类以及卤代酰胺类除草剂联合使用可有效降低除草剂对玉米、谷类作物的毒害影响,对农作物增产具有重要作用,其研究也越来越受到行业研究者的密切关注。本文对呋喃解草唑近年的合成研究进行综述。

1 除草剂安全剂的发展历程
1947年,Hoffmann观察到只有被2,4,6-三氯苯氧乙酸(2,4,6-涕)处理过的番茄植株还存活在含有2,4-二氯苯氧乙酸(2,4-滴)的密闭环境中。1953年,Hoffmann首次报道了2,4,6-涕对2,4-滴处理过的番茄叶片具有拮抗作用,并发现2,4,6-涕对萘乙酸(NAA)、吲哚乙酸(IAA)和2-苯并噻唑氧乙酸(BOA)等植物生长激素处理过的番茄植株也有着相似的拮抗作用。1962年,Hoffmann发现被2,4,6-涕处理过的小麦能免受燕麦灵的药害影响,并在同年提出“安全剂”的概念。1969年, Hoffmann成功研发出安全剂1,8-萘二甲酸酐 (NA),并1972年由Gulfoil公司商品化进入市场,用于减少硫代氨基甲酸酯类和氯代乙酰胺类除草剂对玉米、高粱等作物的药害影响。随后,越来越多的企业和研究机构致力于除草剂安全剂的研究,并开发出解草安、解草酯、解草唑等除草剂安全剂。1989年Monsanto公司成功开发的呋喃解草唑,可以有效解除硫代氨基甲酸酯类、乙酰胺类、咪唑啉酮类和磺酰脲类等除草剂对玉米、高粱等作物的药害影响。
2 安全剂的解毒机理
除草剂在植物体内的代谢较为复杂,普遍认为经历以下几个途径:⑴除草剂被植物吸收进入体内;⑵植物体内的除草剂经过不同酶的催化完成氧化、脱烷基化等反应转化为活性或非活性代谢物;⑶代谢物或者未代谢的外源物质与植物体内的内源物质偶联成无毒轭合物;⑷轭合物继续结合形成不溶的残留物被隔离在植物的液泡中或结合在木质素生物聚合物中。不同植物对除草剂的耐受性不同,在杂草防除过程中除草剂不可避免对农作物产生一定的药害影响,为了避免这种不利影响,除草剂中常常加入安全剂诱导农作物的代谢过程。
安全剂的作用机制可归结为3个假设理论:⑴基于安全剂与除草剂的结构相似性提出的结构活性理论(QSAR)。1978年Stephenson等采用N,N-二烯丙基-2,2-二氯乙酰胺类化合物对玉米进行处理,筛选对丙草丹(EPTC)具有良好解毒活性的化合物。研究发现,与EPTC的化学结构越相似的化合物的解毒活性越强。1982年Ezra等在研究除草剂EPTC和N,N-二烯丙基-2,2-二氯乙酰胺 (DDCA)之间的相互作用时,发现DDCA能够抑制玉米细胞对EPTC的摄取,导致其竞争的主要原因是由于2种物质的结构相似且作用部位相同。1990年 Yenne等使用计算机软件对除草剂和其安全剂进行化学结构模拟发现,安全剂和除草剂分子水平的相似性有利于2者联用的解毒效果。
⑵细胞色素P450单氧酶催化的羟基化理论。1969年Frear等首次报道在棉花幼苗中存在含有细胞色素P450的微粒体,能有效促进非草隆进行N-脱烷基化反应转化为毒性更小的单甲基或脱甲基衍生物,这表明细胞色素P450可能参与了非草隆的 代谢;随着研究的发展,细胞色素P450的作用也逐渐清晰,尤其是安全剂对细胞色素P450的影响。
1994年Cole指出氯乙酰胺类除草剂在作物体内可通过芳基或烷基羟基化代谢为无除草活性代谢物,在代谢过程中安全剂能通过提高细胞色素P450加氧酶含量促进除草剂在作物体内的代谢,Cole认为除草剂的代谢和作物体内各种代谢酶有着重要的关系。2009年刘惠君等使用NA等安全剂和R-异丙基甲草胺等除草剂处理玉米和水稻,检测到经安全剂和除草剂联用处理的作物体内细胞色素P450含量明显高于只经除草剂处理的对照作物,这证明安全剂能诱导作物产生细胞色素P450,从而促进除草剂在作物体内的代谢反应以达到解毒效果。
⑶谷胱甘肽(GSH)轭合理论。1970年Shimabukuro 等在研究玉米解毒机制时发现莠去津和西玛津能与玉米体内的GSH结合转化为无生物活性的GS-莠去津和GS-西玛津结合物,这表明植物体内的GSH对除草剂具有一定解毒作用。1976年Lay等研究发现经安全剂R-25788处理过的玉米可以显著提高GSH的含量和谷胱甘肽S-转移酶(GSTs)的活性,从而促进硫代氨基甲酸酯类除草剂及其亚砜代谢物在作物体内轭合转化成无毒物质,证明了安全剂可通过促进作物的谷胱甘肽轭合解除除草剂的药害影响。1979年Robert等研究发现安全剂R-25788能够提高除草剂在细胞膜上的亚磺化速率,并促进亚砜和GSH轭合,进一步证明安全剂对除草剂与GSH 轭合具有促进作用。2013年赵李霞等研究对氯磺隆解毒过程中发现安全剂R-28725同样能提高玉米中GSTs和乙酰乳酸合成酶(ALS)的活性并增加GSH 的含量,促进作物体内GSH和氯磺隆的轭合作用而减轻除草剂对玉米的药害影响。这些均表明在安全剂诱导的除草剂代谢中谷胱甘肽轭合理论具有一定合理性。
目前尚无呋喃解草唑解毒机制的详细报道,根据黄启凤总结的二氯乙酰胺类安全剂对磺酰脲类除草剂的解毒机理,推测其解毒机理可能存在以下过程:磺酰脲类除草剂通过抑制玉米植株内ALS的活性阻断缬氨酸、亮氨酸和异亮氨酸的合成,并间 接阻断蛋白质和DNA的合成,使核苷二磷酸还原酶 (RDP)的合成受到影响,由于ALS和RDP都属于含硫酶,除草剂的使用导致作物中谷胱甘肽和硫的含量减少,造成除草剂在作物体内的代谢受到抑制而产生蓄积。安全剂通过刺激玉米根部对硫酸盐的利用,增加玉米体内半胱氨酸和GSH的含量,使得玉米植株内ALS的活性增加,并促进除草剂和GSH轭合生成无毒的轭合物。此外,陶波对二氯乙酰胺类安全剂诱导的硫代氨基甲酸酯类除草剂解毒机制的研究表明,硫代氨基甲酸酯类除草剂在作物体内代谢为有毒的亚砜化合物,安全剂通过增加作物体内GSH含量和提高GSTs活性,促进亚砜化合物与GSH轭合成无毒化合物。推测同属于二氯乙酰胺类安全剂的呋喃解草唑对硫代氨基甲酸酯类除草剂具有相同的解毒机制。
3 呋喃解草唑的合成
1989年孟山都公司首次报道了呋喃解草唑的合成(图2)。室温和氮气条件下,呋喃甲醛、三甲基氰硅烷和碘化锌经加成反应后,蒸馏纯化得到化合物2;化合物2于无水无氧乙醚中,经LiAlH4还原、二氯甲烷和乙醚体系重结晶得到化合物3;化合物3于二氯乙烷中与丙酮环合,再经蒸馏分离得到化合物4;化合物4在二氯甲烷中,于冰浴条件下,以10%NaOH为缚酸剂,与二氯乙酰氯经酰化反应后,先柱层析(乙酸乙酯/己烷=10∶90)、再由甲基环己烷重结晶得呋喃解草唑(1),收率50%(以化合物4计)。

1995年孟山都公司再次报道了呋喃解草唑的新合成路线(图3)。在碱性条件下,呋喃甲醛和硝基甲烷进行Henry反应得到化合物5;研究指出在含有H2和催化剂的条件下胺类化合物可以用醛或酮进行衍生化处理,生成伯胺、仲胺或叔胺,通过化 合物5经过还原和衍生化处理后再完成环合反应得到化合物4,既避免了副产物(N-烷基化合物)的生成,又解决了氨基醇难以分离的问题。在实际操作中,研究人员在室温条件下将丙酮和活化后的Ni催化剂加入到不锈钢高压反应器中,再将H2加压到7.0kg/cm2并剧烈搅拌,将含有化合物5的甲基叔丁基醚(MTBE)溶液用高压泵快速打入反应器中,待反应温度升至34℃后不再升高,再将反应液加热至40℃,并使用加压泵缓慢打入相应量的化合物5继续反应“一锅法”合成化合物4(纯度为80.2%, GC)。该反应体系中,丙酮还原会放出一定热量,研究指出向反应体系中多加入1/5反应用量的化合物5会消除该体系中丙酮的还原,同时采用缓慢加料和快速搅拌的方法避免反应体系升温过快;使用氧化钙除去反应中生成的水后,再加入二氯乙酰氯反应得到产物呋喃解草唑(纯度为94.8%,GC)。值得注意的是环合反应产物除使用干燥剂除水外还可使用共沸蒸馏等方法脱除反应体系中的水。与1989年的原研路线相比,硝基甲烷相较于三甲基腈硅烷价廉易得,采用“一锅法”的反应方式明显提高工艺效率。
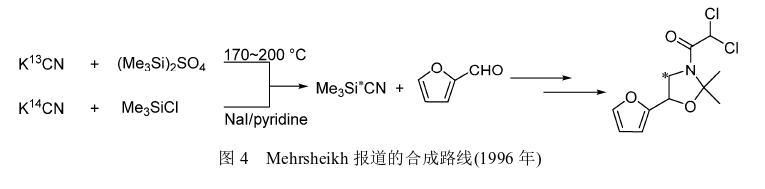
1996年Mehrsheikh为得到能在环境化学和动植物中做代谢研究的呋喃解草唑,使用13C和14C标记的KCN分别与(Me3Si)2SO4、Me3SiCl反应得到13C和14C标记的三甲基氰硅烷(图4),采用原研路线合成13C和14C标记的呋喃解草唑。与原研路线反应方案不同,研究人员在含有对甲苯磺酸的无水甲苯中完成化合物3和丙酮的环合反应得到化合物4,反应过程中生成的水通过回流共沸除去,避免干燥剂的使用;酰化反应中使用三乙胺(TEA)作为缚酸剂,在无水甲苯中化合物4与二氯乙酰氯进行酰化反应得到13C和14C标记的呋喃解草唑,全程收率分别为28%和34%(以呋喃甲醛计)。
2012年黄启凤采用与原研专利相同的路线合成呋喃解草唑(图2),并对各步反应进行了工艺优化,筛选出最优反应条件。以0.23%的ZnI2作为催化剂,呋喃甲醛和三甲基氰硅烷比为1∶1.3(物质的量之比,下同)投料,在15~20℃条件下反应6h合成化合物2;化合物2和LiAlH4以1∶1.1投料,在无水乙醚中回流反应1.5h得到化合物3,确定最佳结晶溶剂为DCM;环合反应中以化合物3和丙酮比为1∶5,对甲苯磺酸的用量为2.6%,苯为溶剂,反应时间为4h作为优选条件合成化合物4;酰化反应优选NaOH为缚酸剂,化合物4、二氯乙酰氯和NaOH的投料比为1∶1.2∶2.4,0~5℃反应12h合成呋喃解草唑,结晶溶剂优选乙醇,全程收率41.9% (以呋喃甲醛计)。与原研方案相比,优化路线在亲核加成阶段未采用无氧环境,后处理时也未使用原研专利中通过蒸馏的方式获得化合物2,而是使用过滤操作,相比于原工艺条件更加简单。此外,还完成不同碱(甲醇钠、三乙胺、氢氧化钠等)催化下呋喃甲醛和硝基甲烷进行Henry反应合成化合物5的探索实验,结果显示在此条件下,主产物是2-(2-硝基乙烯基)-呋喃(6),而化合物5的收率很低。
同年公布的专利中,黄启凤等指出在第3步加成环合反应中温度过高不利于唑烷的生成,之后采用苯代替甲苯进行回流反应使收率得到提高。
2013年丁一等对原研路线进行研究,指出酰化反应中NaOH是最优选的缚酸剂,增加其用量和 酰化反应时间可以提高呋喃解草唑的产率。
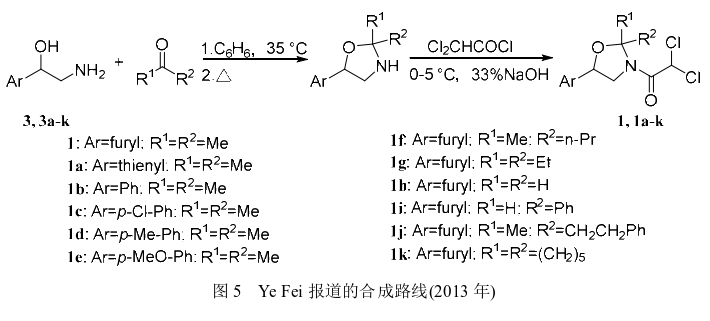
2013年Ye等通过使用α-(氨基甲基)-2-芳基甲醇“一锅法”合成了呋喃解草唑及其系列衍生物 (图5,1a-k)。先将化合物3和丙酮加入苯中,在33~35℃下短暂搅拌后继续升温至回流使反应体系中的水与苯通过共沸除去;反应结束后将反应液冷却至0℃再加入33%NaOH溶液,并在冰浴条件下逐滴加入二氯乙酰氯反应2h得到粗产品;经乙酸乙酯和石油醚的混合溶剂结晶得到呋喃解草唑,收率为91% (以化合物3计)。此外,Ye等还考察了在玉米杂草防除中该系列化合物对氯磺隆的解毒效果,结果表明化合物1h对氯磺隆的解毒效果最好;还通过化合物1b单晶的X射线衍射获得了呋喃解草唑及其衍生物的晶体学信息。
2017年贾庆山等同样对原研路线进行研究,并对反应条件进行了改进。其中包括使用三氟化硼代替ZnI2作为催化剂,并将第1步亲核加成反应与第2步还原反应做成“一锅法”反应。将三氟化硼、呋喃甲醛和三甲基氰硅烷混合均匀后滴加到含有 LiAlH4的非质子溶剂中回流反应(50~60℃),反应液经NaOH淬灭后,通过过滤、干燥、蒸馏等处理得到含化合物3的固体,无需重结晶;在加成环合反应中,研究人员在含化合物3和丙酮的苯溶液中加入甲苯磺酸回流反应,同时向反应体系中通入15%~25%的SO2催化该反应得到化合物4;随后直接向上一步反应液中加入NaOH和二氯乙酰氯进行反应,结束后在低温下萃取、浓缩得到呋喃解草唑。
2019年张越等公开的专利中的合成路线与孟山都公司1995年专利的合成路线相同。在合成过程中,研究人员发现并鉴定了一个重要杂质2,2-二 氯-N-[2-(2-呋喃基)-2-羟基乙基]乙酰胺,推断了该杂质的生成原因,并对其合成方法做了研究。
4 中间体α-(硝基甲基)-2-呋喃甲醇(5) 的合成研究
1995年孟山都公司合成呋喃解草唑的专利中报道了化合物5可以通过呋喃甲醛和硝基甲烷在催化剂存在下发生Henry反应进行制备。一般情况下,Henry反应的催化剂是金属氧化物或金属氢氧化合物,如氢氧化钠、氢氧化钾和氧化钙等,也可以是三乙胺等有机胺类。2012年黄启凤在呋喃解草唑的合成研究中使用了甲醇钠、三乙胺、氢氧化钠等常见的碱性催化剂对Henry反应进行了探索性实验,但化合物5的收率较低。
呋喃甲醛与硝基甲烷发生Henry反应制备化合物5,不仅是合成呋喃解草唑的重要反应,也是很多药物和精细化学品合成中的常见反应,近年来,很多学者对其催化剂进行了较为深入的研究。
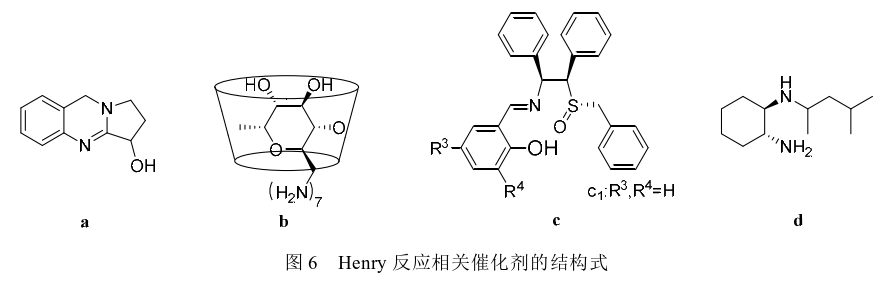
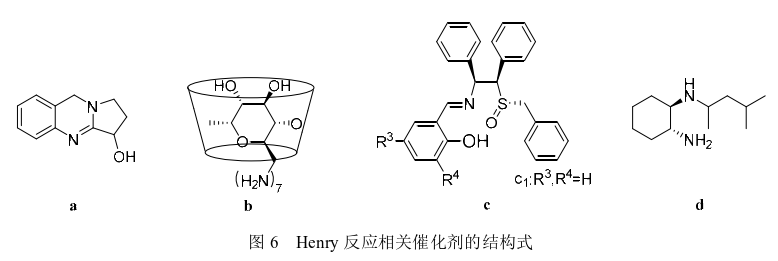
2000年Youn等通过使用LiAlH4作为催化剂,在0℃的条件下催化呋喃甲醛和硝基甲烷反应,以84%的收率得到化合物5。2001年Choudary等通过使用Mg/Al水滑石制备的催化剂催化呋喃甲醛和硝基甲烷的反应,化合物5的收率为73%,指出 其催化机理是Mg/Al水滑石内部含有可溶性碱性中心,该催化剂的优势是反应后容易从反应体系中滤除,避免了复杂的后处理过程。2009年Majhi等使用四甲基乙二胺(TMEDA)作为催化剂在室温条件下催化该反应,以79%的收率得到化合物5。2012年Devi等通过KF浸渍法提高NaY和KL2种沸石的碱性强度,并在甲醇/水体系中使用改性后的NaY沸石催化呋喃甲醛与硝基甲烷反应得到化合物5,收率为72%。同年Pandi等使用八水合氢氧化钡催化硝基甲烷和呋喃甲醛反应,收率为82%。2014年Sarma等使用Lewis碱催化剂[聚(4-乙烯 基吡啶)]以及Lodh等使用阴离子交换树脂 (Ambersep 900OH)均成功催化了呋喃甲醛和硝基甲烷的Henry反应,收率分别为80%和72%,该阴离子交换树脂循环使用3次后收率无明显降低。2016年Sharma等使用一种存在于鸭嘴花中的喹唑啉生物碱(vasicine,图6-a),催化Henry反应合成了化合物5,收率95%。2022年Vishwakarma等使用氟磷灰(FPA)催化该反应以77%收率得到化合物5。除此之外,Phukan等使用咪唑、Allizadeh等使用双胍功能化的磁铁矿纳米颗粒、Haring等使用从鲑鱼精子中提取的ssDNA均成功催化了呋喃甲醛和硝基甲烷反应,虽然收率较低,但却拓展了Henry反应催化剂的种类。
此外,电解催化的Henry反应也引起了研究人员的关注。2004年Palombi等在氩气条件下使用电极电解硝基甲烷后在阴极池中加入呋喃甲醛完成Henry反应得到化合物5,收率63%。2008年Elinson等在NaI-MeOH的电解液体系中电解硝基甲烷完成Henry反应,收率59%。2009年Feroci 等通过铂电极在氩气条件下电解咪唑阳离子得到N-杂环卡宾,该化合物催化呋喃甲醛和硝基甲烷完成Henry反应,收率79%。这些用于合成化合物5的电化学方法无疑给Henry反应提供了新的研究方向。
此外,原研专利中虽有提到呋喃解草唑是具有旋光异构体的化合物,却未能给出该化合物旋光异构体的结构信息。在此后的研究中,也没有报道呋喃解草唑旋光异构体的合成文章,但有关化合物5的旋光异构体合成却被广泛提到。2010年Kanagaraj 等根据环糊精内腔具有疏水性的特性,对环糊精进行化学修饰得到大分子手性主体催化剂per-6-ABCD (图6-b),并成功将该催化剂应用于呋喃甲醛和硝基甲烷的Henry反应中,R-5收率为99%(92%ee)。该催化剂重复使用7次后仍具有较高的收率和对映体选择性。2012年Cheng等设计并合成了一种手性主链连接的亚砜-席夫碱(图6-c),在含有Cu(OAc)·H2O和手性席夫碱配体c1的叔丁醇溶液中呋喃甲醛和硝基甲烷发生Henry反应,R-5收率为91%(95%ee)。2013年Liu等研究获得一种新颖的Cu(Ⅱ)配体(图6-d),该配体与Cu(OAc)2·H2O和三乙胺组成的催化体系在-40℃条件下催化该Henry反应,S-5收率为 99%(87%ee)。虽然目前呋喃解草唑以消旋体获得应用,但是具有旋光性的化合物5的合成方法有望为呋喃解草唑旋光异构体的合成提供一些数据支持。
值得注意的是,在呋喃甲醛和硝基甲烷进行Henry反应的过程中,由于反应条件和化合物本身性质的影响,化合物5非常容易发生分子内脱水形成更加稳定的化合物6,在一定条件下该化合物还会进一步反应生成其他杂质。2004年Ballini等报道了杂质化合物6的生成,并且在过量的硝基甲烷体系中,化合物6会继续与硝基甲烷进行Michael加成反应生成杂质2-(2-呋喃基)-1,3-二硝基丙烷(7)(图7-A)。此研究指出反应温度、碱性环境和较高的硝基甲烷浓度都是影响化合物5转化为化合物6和化合物7的主要因素。此外,2006年Ooi等在含有醛/酮和过量硝基烷烃的己烷或苯的反应液中使用三乙胺或甲醇钠催化Henry反应得到一些低聚合化合物,证明是1,3- 二硝基化合物(9)作为亲核反应供体继续与硝基乙烯基化合物反应生成硝基乙烯基的聚合物(图7-B),较高的反应温度会促进该聚合物的形成。
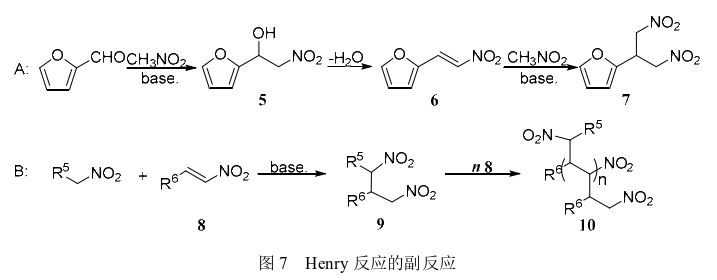
在合成呋喃解草唑中间体化合物5的过程中,化合物6、7、10都可能作为反应的杂质出现,因此,降低反应温度、减少硝基甲烷的用量以及合适的碱性催化剂将会有利于抑制这些杂质的生成,进而提高化合物5的选择性。
5 安全剂呋喃解草唑的应用
在现代农业生产中,安全剂一直以除草剂添加剂的身份出现在商用除草剂中。当安全剂与除草剂联合使用时,可提供良好的植物相容性,从而减少甚至防止除草剂对作物的损害。最初,呋喃解草唑主要与磺酰脲类和咪唑啉酮类等除草剂联合使用解决除草剂对作物的药害影响,近些年,对新型除草剂与呋喃解草唑组合物的研究和应用越来越广泛。
2021年呋喃解草唑已被成功运用到嘧啶羧酸苄酯类、苯甲酰胺类、取代异唑甲酰胺类等除草剂中组合使用。到2022年,有关呋喃解草唑与不同除草剂配伍使用的配方不断被开发。这些组合制剂不但能用于防止除草剂对玉米和谷类等作物的药害,提高选择性,还可有效控制植物病原真菌、细菌等微生物和害虫对作物的不利影响。鉴于安全剂呋喃解草唑的良好表现预计未来会有更多的除草剂制剂配方获得应用。
6 总结与展望
自1962年Hoffmann提出“安全剂”概念,除草剂安全剂的研究开发、生产与应用一直是研究人员关注的热点之一。呋喃解草唑作为一种广泛使用的除草剂安全剂,具有较好的市场前景,获得高效催化剂及优化反应条件以提高呋喃解草唑反应收率是其工业化生产中面临的主要问题;由于硝基甲烷的危险性,呋喃解草唑的连续化工艺开发对实现其经济生产、环境友好工业化生产同样具有重要意义。

